Questão 71689
UEMA
(UEMA - 2013)
Leia o texto a seguir:
As teorias atuais de ligações químicas foram, em grande parte, inspiradas na ideia da união, por meio de pares de elétrons, proposta por G. N. Lewis, em 1916. A ligação ficaria representada por meio de dois pontos, os elétrons, colocados entre os símbolos dos elementos, ou por traços, simbolizando a união (teoria do octeto).
Considere as seguintes fórmulas moleculares dos compostos: SF6, CF4, AlF3, PCl5, CCl4
Com base nas informações anteriores, os compostos que respeitam a teoria do octeto são
CF4 e CCl4
AlF3 e PCl5
SF6 e PCl5
CF4 e SF6
CF4 e AlF3
Gabarito:
CF4 e CCl4
Resolução:
Para determinar se o composto respeita a regra do octeto é preciso analisar a quantidade de elétrons na camada de valência do átomo central. Se esse número for igual a oito, o composto respeita a regra do octeto; se o número for diferente de oito, o número não respeita a regra do octeto.
a) CF4 e CCl4
Estruturas de Lewis dos compostos:
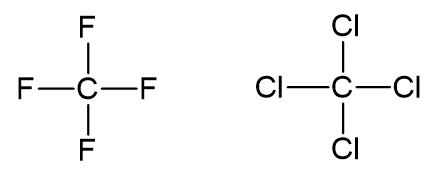
Cada ligação entre o átomo de carbono e os átomos de F ou Cl envolve dois elétrons. Portanto, nos dois compostos o carbono possui 8 elétrons na camada de valência, 2 elétrons de cada ligação.
b) AlF3 e PCl5
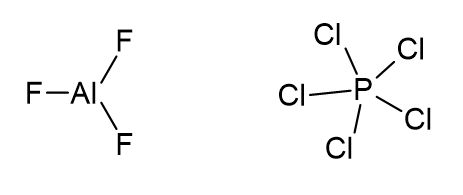
O átomo de alumínio possui seis elétrons na camada de valência, sendo dois de cada ligação Al-F.
O átomo de fósforo possui dez elétrons na camada de valência, sendo dois de cada ligação P-Cl.
Os dois compostos não respeitam a regra do octeto.
c) SF6 e PCl5
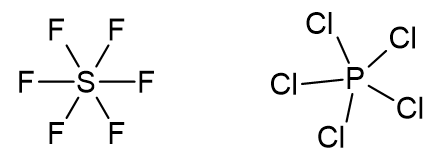
O átomo de enxofre possui doze elétrons na camada de valência, sendo dois de cada ligação S-F.
O átomo de fósforo possui dez elétrons na camada de valência, sendo dois de cada ligação P-Cl.
Os dois compostos não respeitam a regra do octeto.
d) CF4 e SF6
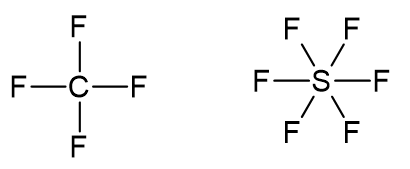
O átomo de carbono possui oito elétrons na camada de valência, sendo dois de cada ligação C-F.
O átomo de enxofre possui doze elétrons na camada de valência, sendo dois de cada ligação S-F.
O CF4 respeita a regra do octeto e o SF6 não.
e) CF4 e AlF3
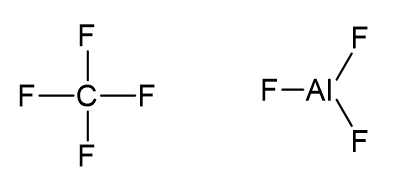
O átomo de carbono possui oito elétrons na camada de valência, sendo dois de cada ligação C-F.
O átomo de alumínio possui seis elétrons na camada de valência, sendo dois de cada ligação Al-F.
O CF4 respeita a regra do octeto e o AlF3 não.