FUVEST 2003
Questão 49695
UNICAMP
(UNICAMP - 2003 - 2 fase - Questão 23)
Os invertebrados como, por exemplo, borboletas, planárias, esponjas, minhocas, baratas, hidras e estrelas-do-mar, podem ser agrupados de acordo com características relativas à excreção.
a) Dentre os animais citados, quais não apresentam estruturas especializadas para a excreção? Explique como é realizada a excreção nestes casos.
b) Os Túbulos de Malpighi têm função excretora. Indique em quais dos animais citados eles ocorrem e explique o mecanismo de excreção nestes animais.
Ver questãoQuestão 49696
UNICAMP
(UNICAMP - 2003 - 2 fase - Questão 24)
Alguns hidrozoários coloniais, como a Obelia sp., ocorrem na natureza sob a forma de pólipos e medusas.
a) Como uma colônia destes hidrozoários se origina? E como esta colônia dá origem a novas colônias?
b) Que estrutura comum aos pólipos e medusas é encontrada somente neste filo? Qual a sua função?
Ver questãoQuestão 49698
UNICAMP
(UNICAMP - 2003 - 2 fase - Questão 1)
Em um jantar de Natal oferecido a amigos, o anfitrião abriu duas garrafas de um mesmo vinho. O conteúdo de uma delas permaneceu intacto enquanto o da outra foi consumido em cerca de 90%. As duas garrafas foram tampadas. A cheia foi guardada na geladeira e a outra num armário da cozinha. Uma semana mais tarde, na ceia de Ano Novo, o conteúdo desta última garrafa foi usado para temperar a salada.
a) O que aconteceu com este vinho para poder ser usado como tempero de salada? Justifique usando uma equação química.
b) Cite dois fatores físicos e/ou químicos que favoreceram a transformação no conteúdo de uma garrafa e não no da outra.
Ver questãoQuestão 49699
UNICAMP
(UNICAMP - 2003 - 2 fase - Questão 2)
As “margarinas”, muito usadas como substitutos da manteiga, contêm gorduras vegetais hidrogenadas. A diferença fundamental entre uma margarina “light” e outra “normal” está no conteúdo de gordura e de água. Colocou -se em um tubo de ensaio uma certa quantidade de margarina “normal” e, num outro tubo de ensaio, idêntico ao primeiro, colocou-se a mesma quantidade de margarina “light”. Aqueceu -se em banho-maria os dois tubos contendo as margarinas até que aparecessem duas fases, como esquematizado na figura.
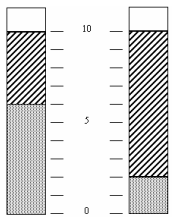
a) Reproduza, na resposta, a figura do tubo correspondente à margarina “light”, identificando as fases lipídica e aquosa.
b) Admitindo que as duas margarinas tenham o mesmo preço e considerando que este preço diz respeito, apenas, ao teor da gordura de cada uma, em qual delas a gordura custa mais e quantas vezes (multiplicação) este preço é maior do que na outra?
Ver questãoQuestão 49700
UNICAMP
(UNICAMP - 2003 - 2 fase - Questão 3)
Os alimentos, além de nos fornecerem as substâncias constituintes do organismo, são também fontes de energia necessária para nossas atividades.
Podemos comparar o balanço en ergético de um indivíduo após um dia de atividades da mesma forma que comparamos os estados final e inicial de qualquer processo químico.
O gasto total de energia (em kJ) por um indivíduo pode ser considerado como a soma de três usos corporais de energia:
1 - gasto metabólico de repouso (4,2 kJ/kg por hora)
2 - gasto energético para digestão e absorção dos alimentos, correspondente a 10% da energia dos alimentos ingeridos.
3 - atividade física, que para uma atividade moderada representa 40% do gasto metabólico de repouso.
a) Qual seria o gasto energético total de um indivíduo com massa corporal de 60 kg, com atividade moderada e que ingere o equivalente a 7600 kJ por dia?
b) Considerando-se que 450 g de massa corporal correspondem a aproximadamente 15000 kJ, qual é o ganho (ou perda) deste indivíduo por dia, em gramas?
Questão 49701
UNICAMP
(UNICAMP - 2003 - 2 fase - Questão 4)
A vitamina C, também conhecida como ácido ascórbico, é um composto orgânico, hidrossolúvel, estável ao aquecimento moderado apenas na ausência de oxigênio ou de outros oxidantes. Pode ser transformada em outros produtos pelo oxigênio do ar, em meio alcalino ou por temperaturas elevadas. Durante processos de cozimento, alimentos que contêm vitamina C apresentam perdas desta vitamina, em grande parte pela solubilização na água e, também, por alterações químicas. Em função disto, para uso doméstico, deve-se evitar o cozimento prolongado, altas temperaturas e o preparo do alimento com muita antecedência ao consumo.
A análise quantitativa do ácido ascórbico em sucos e alimentos pode ser feita por titulação com solução de iodo, I2. A seguinte equação representa a transformação que ocorre nesta titulação.
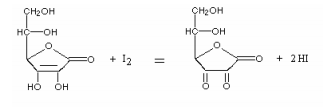
a) Esta reação é de oxido-redução? Justifique.
Diferentemente da maioria dos ácidos orgânicos, a vitamina C não apresenta grupo carboxílico em sua molécula.
b) Escreva uma equação química correspondente à dissociação iônica do ácido ascórbico em água, que justifique o seu caráter ácido.
Ver questãoQuestão 49702
UNICAMP
(UNICAMP - 2003 - 2 fase - Questão 5)
A ingestão de cloreto de sódio, na alimentação, é essencial. Excessos, porém, causam problemas, principalmente de hipertensão. O consumo aconselhado para um adulto, situa-se na faixa de 1100 a 3300 mg de sódio por dia. Pode-se preparar uma bela e apetitosa salada misturando-se 100 g de agrião (33 mg de sódio), 100 g de iogurte (50 mg de sódio) e uma xícara de requeijão cremoso (750 mg de sódio), consumindo-a acompanhada com uma fatia de pão de trigo integral (157 mg de sódio):
a) Que percentual da necessidade diária mínima de sódio foi ingerido?
b) Quantos gramas de cloreto de sódio deveriam ser adicionados à salada, para atingir o consumo diário máximo de sódio aconselhado?
Ver questãoQuestão 49703
UNICAMP
(UNICAMP - 2003 - 2 fase - Questão 6)
Fontes vegetais de lipídios contêm moléculas de ácidos graxos (ácidos carboxílicos poli-insaturados) que apresentam estrutura cis. O processo de hidrogenação parcial destas gorduras, como por exemplo na fabricação de margarinas, pode conduzir à formação de isômeros trans, que não são desejáveis, visto que estes são suspeitos de elevarem o teor de colesterol no sangue.
a) Escreva a equação química que representa, genericamente, a hidrogenação de uma dupla ligação carbono-carbono ( >C = C<) O ácido linoléico pode ser representado pela fórmula C18H32O2.
b) Quantas duplas ligações( >C = C<)contêm uma molécula deste ácido? Justifique
Ver questãoQuestão 49704
UNICAMP
(UNICAMP - 2003 - 2 fase - Questão 7)
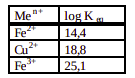
Íons como Cu2+ , Fe3+ e Fe2+ , presentes em certos alimentos, como por exemplo maionese, podem causar a sua deterioração através da formação de peróxidos. Para evitar este problema, em alguns alimentos industrializados pode ser adicionada uma substância que comp lexa (reage com) estes íons, impedindo a sua ação. Esta substância, genericamente conhecida como “EDTA”, é adicionada na forma de seu sal de sódio e cálcio. A reação que ocorre entre os íons “indesejáveis” e o “EDTA” adicionado pode ser representada pela e quação:
Os valores dos logaritmos das constantes de equilíbrio para as reações de complexação desses íons com EDTA são:
Questão 49705
UNICAMP
(UNICAMP - 2003 - 2 fase - Questão 8)
O cloreto de potássio é muitas vezes usado em dietas especiais como substituto de cloreto de sódio. O gráfico abaixo mostra a variação do sabor de uma solução aquosa de cloreto de potássio em função da concentração deste sal. Ao se preparar uma sopa (1,5 litros), foi colocada a quantidade mínima de KCl necessária para se obter sabor “salgado”, sem as componentes “amargo”e “doce”.
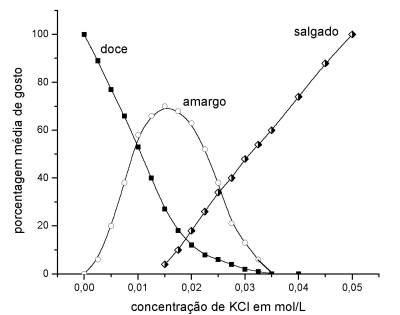
a) Qual a quantidade, em gramas, de KCl adicionado à sopa?
b) Qual a pressão osmótica p, a 57 º C, desta solução de KCl? p = cRT, onde c é a concentração de partículas em mol/L, R = 0,082 L atm K-1mol –1 , T é a temperatura absoluta.
Ver questão