FUVEST 2006
Questão 44849
FUVEST
(FUVEST - 2006)
O valor biológico proteico dos alimentos é avaliado comparando-se a porcentagem dos aminoácidos, ditos “essenciais”, presentes nas proteínas desses alimentos, com a porcentagem dos mesmos aminoácidos presentes na proteína do ovo, que é tomada como referência. Quando, em um determinado alimento, um desses aminoácidos estiver presente em teor inferior ao do ovo, limitará a quantidade de proteína humana que poderá ser sintetizada. Um outro alimento poderá compensar tal deficiência no referido aminoácido. Esses dois alimentos conterão “proteínas complementares” e, juntos, terão um valor nutritivo superior a cada um em separado.
Na tabela que se segue, estão as porcentagens de alguns aminoácidos “essenciais” em dois alimentos em relação às do ovo (100%).

a) Explique por que a combinação “arroz com feijão” é adequada em termos de “proteínas complementares”. A equação que representa a formação de um peptídio, a partir dos aminoácidos isoleucina e valina, é dada abaixo.
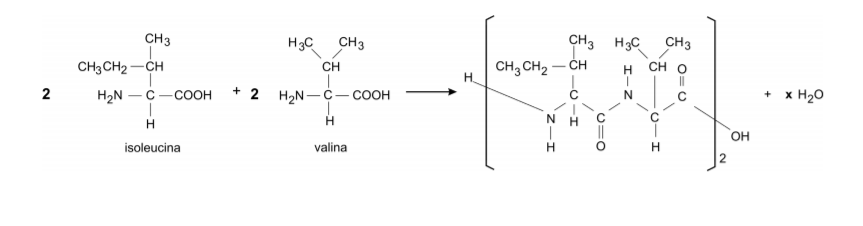
b) Mostre, com um círculo, na fórmula estrutural do peptídio, a parte que representa a ligação peptídica.
c) Determine o valor de x na equação química dada.
d) 100 g de proteína de ovo contêm 0,655g de isoleucina e 0,810 g de valina. Dispondo-se dessas massas de aminoácidos, qual a massa aproximada do peptídio, representado na página ao lado, que pode ser obtida, supondo reação total? Mostre os cálculos.
|
Massa molar (g/mol): valina ..............117 isoleucina .......131 água .................18 |
Ver questão
Questão 44850
FUVEST
(FUVEST - 2006)
Considere os seguintes dados:
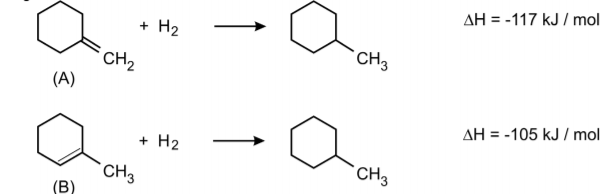
a) Qual dos alcenos (A ou B) é o mais estável? Justifique. Neste caso, considere válido raciocinar com entalpia.
A desidratação de álcoois, em presença de ácido, pode produzir uma mistura de alcenos, em que predomina o mais estável.
b) A desidratação do álcool 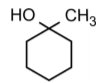 , em presença de ácido, produz cerca de 90% de um determinado alceno. Qual deve ser a fórmula estrutural desse alceno? Justifique.
, em presença de ácido, produz cerca de 90% de um determinado alceno. Qual deve ser a fórmula estrutural desse alceno? Justifique.
Questão 44851
FUVEST
(FUVEST - 2006)
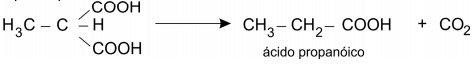
O malonato de dietila e o acetoacetato de etila podem ser empregados para preparar, respectivamente, ácidos carboxílicos e cetonas. A preparação de um ácido, a partir do malonato de dietila, é feita na sequência:
Reação I. Formação de um sal de sódio
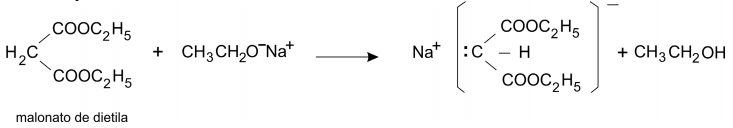
Reação II. Introdução de grupo alquila
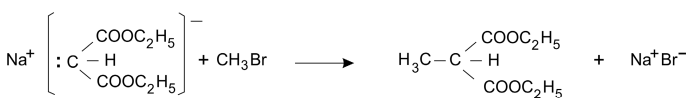
Reação III. Hidrólise ácida
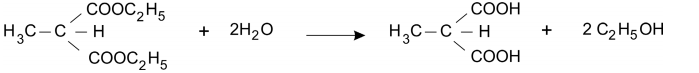
Reação IV. Perda de CO2 por aquecimento
Analogamente, pode-se obter a 2-hexanona partindo-se do acetoacetato de etila:
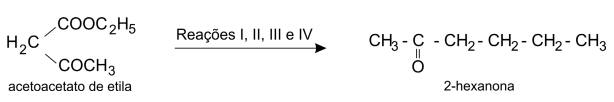
Dê as quatro equações químicas que representam as reações I, II, III e IV para essa transformação.
Ver questãoQuestão 44852
FUVEST
(FUVEST - 2006)
Constrói-se uma pilha formada por:
• um eletrodo, constituído de uma placa de prata metálica, mergulhada em uma solução aquosa de nitrato de prata de concentração 0,1 mol / L.
• outro eletrodo, constituído de uma placa de prata metálica, recoberta de cloreto de prata sólido, imersa em uma solução aquosa de cloreto de sódio de concentração 0,1 mol / L.
• uma ponte salina de nitrato de potássio aquoso, conectando esses dois eletrodos. Constrói-se outra pilha, semelhante à primeira, apenas substituindo-se AgCl (s) por AgBr (s) e NaCl (aq, 0,1 mol/L) por NaBr (aq, 0,1 mol / L).
Em ambas as pilhas, quando o circuito elétrico é fechado, ocorre produção de energia.
a) Dê a equação global da reação da primeira pilha. Justifique o sentido em que a transformação se dá.
b) Dê a equação da semi-reação que ocorre no pólo positivo da primeira pilha.
c) Qual das pilhas tem maior força eletromotriz? Justifique sua resposta com base nas concentrações iônicas iniciais presentes na montagem dessas pilhas e na tendência de a reação da pilha atingir o equilíbrio.
Para a primeira pilha, as equações das semi-reações de redução, em meio aquoso, são:
Produtos de solubilidade:AgCl..... 1,8 ×10-10 ; AgBr ....5,4 × 10-13
Ver questão
Questão 44872
FUVEST
(FUVEST - 2006)
O Ministério da Agricultura estabeleceu um novo padrão de qualidade e identidade da cachaça brasileira, definindo limites para determinadas substâncias formadas na sua fabricação. Algumas dessas substâncias são ésteres, aldeídos e ácidos carboxílicos voláteis, conforme o caderno Agrícola de 08 de junho de 2005, do jornal O Estado de S. Paulo. Nesse processo de fabricação, pode ter ocorrido a formação de
I. ácido carboxílico pela oxidação de aldeído.
II. éster pela reação de álcool com ácido carboxílico.
III. aldeído pela oxidação de álcool.
É correto o que se afirma em
Ver questãoQuestão 44873
FUVEST
(FUVEST - 2006 - 1 FASE )
Os desenhos são representações de moléculas em que se procura manter proporções corretas entre raios atômicos e distâncias internucleares. Os desenhos podem representar, respectivamente, moléculas de
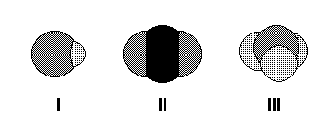
Ver questão
Questão 44877
FUVEST
(FUVEST - 2006 - 1 FASE )
Embalagens de fertilizantes do tipo NPK trazem três números, compostos de dois algarismos, que se referem, respectivamente, ao conteúdo de nitrogênio, fósforo e potássio, presentes no fertilizante. O segundo desses números dá o conteúdo de fósforo, porém expresso como porcentagem, em massa, de pentóxido de fósforo. Para preparar 1 kg de um desses fertilizantes, foram utilizados 558 g de mono-hidrogenofosfato de amônio e 442 g de areia isenta de fosfatos. Na embalagem desse fertilizante, o segundo número, relativo ao fósforo, deve ser, aproximadamente,
Massa molar (g/mol)
mono-hidrogenofosfato de amônio................ 132
pentóxido de fósforo...................................... 142
Ver questãoQuestão 44879
FUVEST
(FUVEST - 2006 - 1 FASE )
O tanque externo do ônibus espacial Discovery carrega, separados, 1,20x106 L de hidrogênio líquido a –253 ºC e 0,55x106 L de oxigênio líquido a –183 ºC. Nessas temperaturas, a densidade do hidrogênio é 34 mol/L (equivalente a 0,068 g/mL) e a do oxigênio é 37 mol/L (equivalente a 1,18 g/mL).
Massa molares (g/mol)
H --- 1g
O ---- 16g
Considerando o uso que será feito desses dois líquidos, suas quantidades (em mols), no tanque, são tais que há
Ver questãoQuestão 44880
FUVEST
(FUVEST - 2006 - 1 FASE )
A efervescência observada, ao se abrir uma garrafa de champanhe, deve-se à rápida liberação, na forma de bolhas, do gás carbônico dissolvido no líquido. Nesse líquido, a concentração de gás carbônico é proporcional à pressão parcial desse gás, aprisionado entre o líquido e a rolha. Para um champanhe de determinada marca, a constante de proporcionalidade (k) varia com a temperatura, conforme mostrado no gráfico.
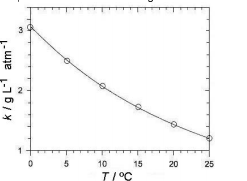
Uma garrafa desse champanhe, resfriada a 12 ºC, foi aberta à pressão ambiente e 0,10 L de seu conteúdo foram despejados em um copo. Nessa temperatura, 20% do gás dissolvido escapou sob a forma de bolhas. O número de bolhas liberadas, no copo, será da ordem de

Questão 44884
FUVEST
(FUVEST - 2006 - 1 FASE )
Preparam-se duas soluções saturadas, uma de oxalato de prata (Ag2C2O4) e outra de tiocianato de prata (AgSCN). Esses dois sais têm, aproximadamente, o mesmo produto de solubilidade (da ordem de 12.10−12). Na primeira, a concentração de íons prata é [Ag+]1 e, na segunda, [Ag+]2 ; as concentrações de oxalato e tiocianato são, respectivamente, [C2O4-2] e [SCN-] . Nesse caso, é correto afirmar que:
Ver questão