FUVEST 2008
Questão 44907
FUVEST
(FUVEST - 2008 - 1ª FASE) Muitos acreditam ser mais saudável consumir “produtos orgânicos” do que produtos cultivados de forma convencional. É possível diferenciar esses dois tipos de produtos, determinando-se as quantidades relativas de e
em cada um deles. Essas quantidades relativas serão diferentes, se o solo for adubado com esterco ou fertilizantes sintéticos. O esterco contém compostos originados no metabolismo animal, enquanto fertilizantes sintéticos, como, por exemplo, o nitrato de amônio, provêm da amônia.
Considere as afirmações:
I. e
diferem quanto ao número de prótons, mas não quanto ao número de nêutrons.
II. Os fertilizantes nitrogenados, sejam sintéticos ou naturais, fornecem o nitrogênio necessário à formação de aminoácidos e proteínas nos vegetais.
III. O fertilizante nitrato de amônio pode ser obtido pela reação da amônia com o ácido nítrico.
É correto apenas o que se afirma em
Ver questãoQuestão 44908
FUVEST
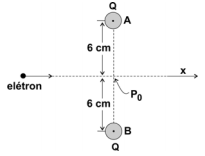
(FUVEST 2008 - 2ª FASE) Duas pequenas esferas iguais, A e B, carregadas, cada uma, com uma carga elétrica Q igual a – 4,8 x 10–9 C, estão fixas e com seus centros separados por uma distância de 12 cm. Deseja-se fornecer energia cinética a um elétron, inicialmente muito distante das esferas, de tal maneira que ele possa atravessar a região onde se situam essas esferas, ao longo da direção x, indicada na figura, mantendo-se eqüidistante das cargas.
a) Esquematize, na figura da página de respostas, a direção e o sentido das forças resultantes F1 e F2, que agem sobre o elétron quando ele está nas posições indicadas por P1 e P2.
b) Calcule o potencial elétrico V, em volts, criado pelas duas esferas no ponto P0.
c) Estime a menor energia cinética E, em eV, que deve ser fornecida ao elétron, para que ele ultrapasse o ponto P0 e atinja a região à direita de P0 na figura.

Questão 44909
FUVEST
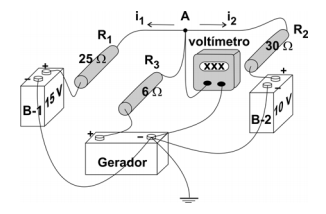
(FUVEST 2008 - 2ª FASE) Utilizando-se um gerador, que produz uma tensão V0, deseja-se carregar duas baterias, B-1 e B-2, que geram respectivamente 15 V e 10 V, de tal forma que as correntes que alimentam as duas baterias durante o processo de carga mantenham-se iguais (i1 = i2 = i). Para isso, é utilizada a montagem do circuito elétrico representada ao lado, que inclui três resistores R1, R2 e R3, com respectivamente 25 Ω, 30 Ω e 6 Ω, nas posições indicadas. Um voltímetro é inserido no circuito para medir a tensão no ponto A.
a) Determine a intensidade da corrente i, em ampères, com que cada bateria é alimentada.
b) Determine a tensão VA, em volts, indicada pelo voltímetro, quando o sistema opera da forma desejada.
c) Determine a tensão V0, em volts, do gerador, para que o sistema opere da forma desejada.
Questão 44910
FUVEST
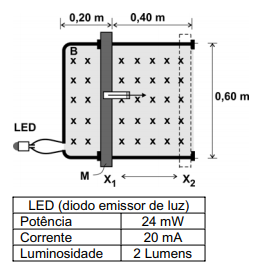
(FUVEST 2008 - 2ª FASE) É possível acender um LED, movimentando-se uma barra com as mãos? Para verificar essa possibilidade, um jovem utiliza um condutor elétrico em forma de U, sobre o qual pode ser movimentada uma barra M, também condutora, entre as posições X1 e X2. Essa disposição delimita uma espira condutora, na qual é inserido o LED, cujas características são indicadas na tabela ao lado. Todo o conjunto é colocado em um campo magnético B( perpendicular ao plano dessa folha e entrando nela), com intensidade de 1,1 T. O jovem, segurando em um puxador isolante, deve fazer a barra deslizar entre X1 e X2. Para verificar em que condições o LED acenderia durante o movimento, estime:
a) A tensão V, em Volts, que deve ser produzida nos terminais do LED, para que ele acenda de acordo com suas especificações.
b) A variação do fluxo do campo magnético através da espira, no movimento entre X1 e X2.
c) O intervalo de tempo , em s, durante o qual a barra deve ser deslocada entre as duas posições, com velocidade constante, para que o LED acenda.

Questão 44911
FUVEST
(FUVEST - 2008 - 1ª FASE)
A velocidade com que um gás atravessa uma membrana é inversamente proporcional à raiz quadrada de sua massa molar. Três bexigas idênticas, feitas com membrana permeável a gases, expostas ao ar e inicialmente vazias, foram preenchidas, cada uma, com um gás diferente. Os gases utilizados foram hélio, hidrogênio e metano, não necessariamente nesta ordem. As bexigas foram amarradas, com cordões idênticos, a um suporte. Decorrido algum tempo, observou-se que as bexigas estavam como na figura. Conclui-se que as bexigas A, B e C foram preenchidas, respectivamente, com
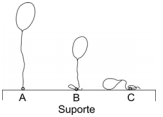
Dados: massas molares (g/mol):
H --- 1,0; He --- 4,0; C --- 12
Massa molar média do ar --- 29 g/mol
Ver questãoQuestão 44912
FUVEST
(FUVEST - 2008 - 1ª FASE) O seguinte fragmento (adaptado) do livro Estação Carandiru, de Drauzio Varella, refere-se à produção clandestina de bebida no presídio:
“O líquido é transferido para uma lata grande com um furo na parte superior, no qual é introduzida uma mangueirinha conectada a uma serpentina de cobre. A lata vai para o fogareiro até levantar fervura. O vapor sobe pela mangueira e passa pela serpentina, que Ezequiel esfria constantemente com uma caneca de água fria. Na saída da serpentina, emborcada numa garrafa, gota a gota, pinga a maria-louca (aguardente). Cinco quilos de milho ou arroz e dez de açúcar permitem a obtenção de nove litros da bebida.”
Na produção da maria-louca, o amido do milho ou do arroz é transformado em glicose. A sacarose do açúcar é transformada em glicose e frutose, que dão origem a dióxido de carbono e etanol.
Dentre as equações químicas,
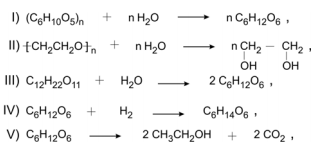
as que representam as transformações químicas citadas são
Dado:
= glicose ou frutose
Questão 44913
FUVEST
(FUVEST 2008 - 2ª fase) Devido à toxicidade do mercúrio, em caso de derramamento desse metal, costuma-se espalhar enxofre no local para removê-lo. Mercúrio e enxofre reagem, gradativamente, formando sulfeto de mercúrio. Para fins de estudo, a reação pode ocorrer mais rapidamente, se as duas substâncias forem misturadas num almofariz. Usando esse procedimento, foram feitos dois experimentos. No primeiro, 5,0 g de mercúrio e 1,0 g de enxofre reagiram, formando 5,8 g do produto, sobrando 0,2 g de enxofre. No segundo experimento, 12,0 g de mercúrio e 1,6 g de enxofre forneceram 11,6 g do produto, restando 2,0 g de mercúrio.
a) Mostre que os dois experimentos estão de acordo com a lei da conservação da massa (Lavoisier) e a lei das proporções definidas (Proust).
b) Existem compostos de Hg (I) e de Hg (II). Considerando os valores das massas molares e das massas envolvidas nos dois experimentos citados, verifique se a fórmula do composto formado, em ambos os casos, é ou
. Mostre os cálculos.
Questão 44914
FUVEST
(FUVEST 2008 - 2ª fase) Um dos métodos industriais de obtenção de zinco, a partir da blenda de zinco, ZnS, envolve quatro etapas em seqüência:
I) Aquecimento do minério com oxigênio (do ar atmosférico), resultando na formação de óxido de zinco e dióxido de enxofre.
II) Tratamento, com carvão, a alta temperatura, do óxido de zinco, resultando na formação de zinco e monóxido de carbono.
III) Resfriamento do zinco formado, que é recolhido no estado líquido.
IV) Purificação do zinco por destilação fracionada. Ao final da destilação, o zinco líquido é despejado em moldes, nos quais se solidifica.
a) Represente, por meio de equação química balanceada, a primeira etapa do processo.
b) Indique o elemento que sofreu oxidação e o elemento que sofreu redução, na segunda etapa do processo. Justifique.
c) Indique, para cada mudança de estado físico que ocorre na etapa IV, se ela é exotérmica ou endotérmica.
Ver questãoQuestão 44915
FUVEST
(FUVEST 2008 - 2ª fase) Em um exame, para o preenchimento de uma vaga de químico, as seguintes fórmulas estruturais foram apresentadas ao candidato:
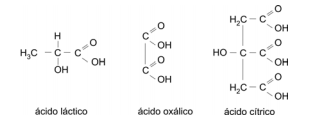
A seguir, o examinador pediu ao candidato que determinasse, experimentalmente, o calor liberado ao fazer-se a mistura de volumes definidos de duas soluções aquosas, de mesma concentração, uma de hidróxido de sódio e outra de um dos três ácidos carboxílicos apresentados, sem revelar qual deles havia sido escolhido. Foi informado ao candidato que, quando o ácido e a base reagem na proporção estequiométrica, o calor liberado é máximo.
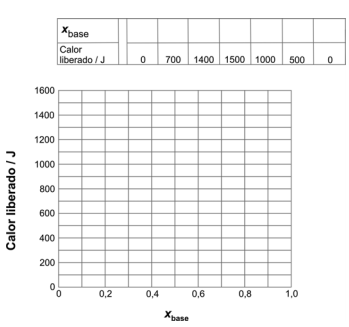
Os resultados obtidos foram os seguintes:

Diante dos resultados obtidos, o examinador pediu ao candidato que determinasse qual dos ácidos havia sido utilizado no experimento. Para responder, o candidato construiu uma tabela e um gráfico do calor liberado versus xbase, definido como:
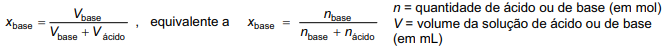
a) Reproduza, na página ao lado, a tabela e o gráfico que devem ter sido obtidos pelo candidato. Pelos pontos do gráfico, podem ser traçadas duas retas, cujo cruzamento corresponde ao máximo calor liberado.
b) Determine o valor de que corresponde ao ponto de cruzamento das retas em seu gráfico.
c) Qual foi o ácido escolhido pelo examinador? Explique.
d) Indique qual é o reagente limitante para o experimento em que o calor liberado foi 1400 J e para aquele em que o calor liberado foi 1500 J. Explique.
Questão 44917
FUVEST
(FUVEST 2008 - 2ª fase) A adição de HCl a alcenos ocorre em duas etapas. Na primeira delas, o íon , proveniente do HCl, liga-se ao átomo de carbono da dupla ligação que está ligado ao menor número de outros átomos de carbono. Essa nova ligação (C-H) é formada à custa de um par eletrônico da dupla ligação, sendo gerado um íon com carga positiva, chamado carbocátion, que reage imediatamente com o íon cloreto, dando origem ao produto final. A reação do 1-penteno com HCl, formando o 2-cloropentano, ilustra o que foi descrito.
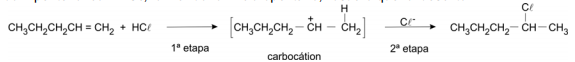
a) Escreva a fórmula estrutural do carbocátion que, reagindo com o íon cloreto, dá origem ao seguinte haleto de alquila:
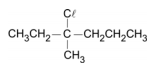
b) Escreva a fórmula estrutural de três alcenos que não sejam isômeros cis-trans entre si e que, reagindo com HCl, podem dar origem ao haleto de alquila do item anterior.
c) Escreva a fórmula estrutural do alceno do item b que não apresenta isomeria cis-trans. Justifique.
Ver questão