FUVEST 2016
Questão 53556
UFPR
(UFPR - 2016 - 2ª FASE)
Considere o triângulo ao lado.
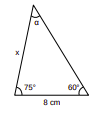
a) Quanto mede o ângulo α?
b) Quanto mede x?
Ver questãoQuestão 53557
UFPR
(UFPR - 2016 - 2ª FASE)
Dada a função polinomial faça o que se pede:
a) Calcule .
b) Encontre as raízes de p(x).
Ver questãoQuestão 53562
UFPR
(UFPR - 2016 - 2ª FASE)
A estrutura molecular que compõe as fibras dos tecidos define o comportamento deles, como maciez, absorção de umidade do corpo e tendência ao encolhimento. As fibras de algodão contêm, em maior proporção, celulose, um polímero carboidrato natural. Já os tecidos sintéticos de poliéster têm propriedades diferentes do algodão. O poliéster é uma classe de homopolímeros e copolímeros que contém o grupo funcional éster na sua estrutura, como o politereftalato de etileno.
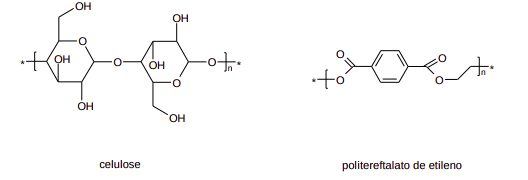
a) Tecidos de algodão absorvem muito bem a umidade, diferentemente do poliéster. Com base nas estruturas químicas mostradas, escreva um texto explicando a razão pela qual a fibra do algodão apresenta essa propriedade.
b) Roupas de tecidos de algodão tendem a encolher após as primeiras lavagens, principalmente se secas em secadoras, diferentemente dos tecidos de poliéster. Isso ocorre porque as fibras de algodão são esticadas a altas tensões no processo de tecelagem. Porém esse estado tensionado não é o mais estável da fibra. Com o movimento proporcionado pela lavagem e o aquecimento na secadora, as fibras tendem a relaxar para conformação mais estável, causando o encolhimento. Escreva um texto explicando qual é o tipo de interação responsável por atrair as fibras e resultar no encolhimento do tecido.
Ver questãoQuestão 53563
UFPR
(UFPR - 2016 - 2ª FASE)
O cromo é um metal bastante utilizado em processos industriais e seu descarte impróprio causa diversas preocupações devido à sua alta toxicidade, no estado de Cr(VI), em humanos, animais e plantas. Recentemente, pesquisadores propuseram uma forma de tratar resíduos de Cr(VI) utilizando um agente redutor natural, a epigalocatequina galato (EGCG), um polifenol presente nas folhas de chá verde. A EGCG reduz Cr(VI) a Cr(III), que é menos tóxico e tende a precipitar ou a se ligar ao solo em meio alcalino. O estudo cinético dessa reação foi realizado em três concentrações diferentes de Cr(VI), em pH = 6,86, temperatura ambiente e em concentração de EGCG muito superior a de Cr(VI), condição em que se pode considerar que [EGCG] permanece praticamente inalterada. Os dados de concentração inicial de cromo VI ([Cr(VI)]0) e velocidade inicial (v0) são mostrados na tabela:
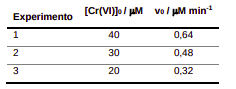
(Fonte: Liu, K., Shi, Z., Zhou, S., Reduction of hexavalent chromium using epigallocatechin gallate in aqueous solutions: kinetics and mechanism, RSC Advances, 2016, 6, 67196.)
a) Forneça a lei de velocidade para a reação mencionada.
b) Qual é a ordem de reação com relação a Cr(VI)? Por quê?
c) Qual é o valor da constante cinética observável kobs (kobs = k[EGCG]y ) dessa reação? Mostre o cálculo.
Ver questãoQuestão 53564
UFPR
(UFPR - 2016 - 2ª FASE)
Numa atividade física intensa, as células do tecido muscular de um atleta demandam energia. Essa energia é armazenada na forma de moléculas de ATP (adenosina trifosfato) e pode ser obtida através da conversão de ATP em ADP (adenosina difosfato), conforme mostrado na equação (I). Essa reação em condição intracelular fornece uma energia livre de Gibbs = -11,5 kcal mol-1 .
A creatina (M = 131 g mol-1 ) é um dos suplementos mais populares utilizados atualmente por atletas. A ingestão de creatina faz com que aumente a concentração de fosfocreatina dentro da célula do tecido muscular. A fosfocreatina reage com ADP, produzindo ATP através de uma reação enzimática, mostrada na equação de equilíbrio (II).
a) Durante esforço físico intenso, o que acontece com a razão entre as concentrações [creatina] / [fosfocreatina] dentro da célula do tecido muscular?
b) Como se pode prever isso utilizando o Princípio de Le Châtelier?
c) Qual é a quantidade de energia gerada através da hidrólise de ATP proveniente exclusivamente da ingestão de 3 g de creatina, admitindo-se que toda essa creatina é acumulada na forma de fosfocreatina nas células? (Utilize uma casa decimal nos cálculos)
Ver questãoQuestão 53565
UFPR
(UFPR - 2016 - 2ª FASE)
É comum as pessoas observarem que ao cozinhar brócolis em água e panela tampada, o vegetal perde a cor verde e adquire uma cor amarelada. Isso ocorre porque compostos voláteis ácidos presentes no vegetal se desprendem pela ação da temperatura de cozimento e reagem com a clorofila, pigmento verde, produzindo feofitina, que é um pigmento amarelo. Para manter a cor verde no brócolis, recomenda-se não tampar a panela ou adicionar bicarbonato de sódio (NaHCO3).
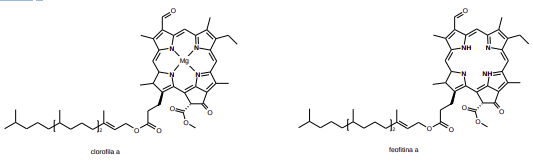
a) De que maneira o bicarbonato de sódio age para evitar a perda da cor verde no brócolis?
b) Por que não tampar a panela produz o mesmo efeito da adição de bicarbonato?
c) Escreva a equação química balanceada da reação envolvida pelo bicarbonato de sódio que explica a resposta do item “a”.
Ver questãoQuestão 53566
UFPR
(UFPR - 2016 - 2ª FASE)
Policlorobifenila, conhecido como PCB, é uma classe de compostos sintéticos aromáticos que foi extensivamente utilizada em fluidos refrigerantes para transformadores, capacitores e motores elétricos, devido à excelente propriedade dielétrica e estabilidade química. O descarte inapropriado de PCB no meio ambiente causa diversos problemas, em função da alta toxicidade e longevidade no ambiente. Os PCBs são agentes carcinogênicos para humanos e animais. A remediação de solos contaminados com PCB é bastante difícil, devido à alta estabilidade desses compostos. A incineração desses solos em temperaturas inferiores a 700 °C produz compostos voláteis perigosos, como as dioxinas. Dioxinas são ainda mais tóxicas e são agentes carcinogênicos e teratogênicos. A equação a seguir corresponde à reação de oxidação de 1,1'-bifenila, 2,2',3,3'-tetracloro (= 73,2 kJ mol-1 ) em 2,3,7,8-tetraclorodibenzop-dioxina (
= -114,4 kJ mol-1 ). A entalpia de formação da água nas condições de reação é (
= -241,8 kJ mol-1 ).
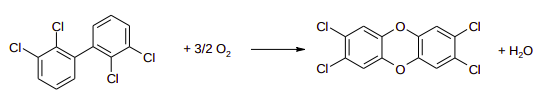
a) Calcule a entalpia da reação ilustrada. Mostre como chegou ao valor.
b) Essa reação é endotérmica? Explique como se chega a tal conclusão
Ver questãoQuestão 53567
UFPR
(UFPR - 2016 - 2ª FASE)
O ano 2016 corresponde ao aniversário de centenário do artigo “The Atom and the Molecule”, publicado por Gilbert N. Lewis em 1916, no qual ele propôs seu modelo de compartilhamento de pares de elétrons na ligação. Desse modelo se desenvolveram os diagramas (diagramas de Lewis) e a regra do octeto. Originalmente, Lewis denominou seu modelo de Teoria do Átomo Cúbico, em que os átomos possuiriam uma estrutura eletrônica rígida num caroço e elétrons móveis na camada de valência, que se dispõe formando um cubo. Na ligação química, os átomos compartilhariam arestas ou faces dos cubos de modo a preencher oito elétrons nos vértices de cada átomo. No esquema abaixo está ilustrado o átomo de cloro, que possui 7 elétrons (círculos nos vértices) na camada de valência. Dois átomos se unem por uma aresta para formar a molécula de Cl2, preenchendo os 8 elétrons, 1 em cada vértice de cada átomo.
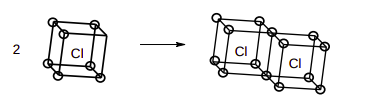
a) O átomo de oxigênio possui número atômico 8. Quantos elétrons pertencem ao “caroço” e quantos estão na camada de valência?
b) Desenhe a estrutura do átomo de oxigênio segundo o modelo do átomo cúbico.
c) Desenhe a estrutura da molécula de O2 segundo o modelo do átomo cúbico. Nessa molécula, os átomos estão conectados por uma aresta ou face do cubo? Justifique.
Ver questão
Questão 53568
UFPR
(UFPR - 2016 - 2ª FASE)
A formação de ligações carbono-carbono (C-C) é um grande desafio na química orgânica, e entre as estratégias disponíveis, pode-se citar a Reação de Grignard. Nessa reação, um halogeneto de alquila ou arila (R-X) reage com magnésio metálico (Mgo ), levando ao organomagnésio correspondente (RMgX), adicionando-se, na sequência, um composto carbonilado (R’COR). A reação termina com a adição de um ácido mineral (H3O+ ), levando ao produto a partir da formação de uma nova ligação C-C.
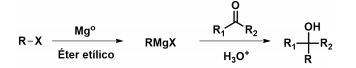
Com relação ao emprego dos reagentes brometo de etila (bromoetano) e acetaldeído (etanal) na Reação de Grignard, responda:
a) Qual é a fórmula estrutural (notação em bastão) do produto formado?
b) Qual é a função orgânica presente no produto?
c) Qual é o nome oficial IUPAC da substância obtida como produto?
Ver questãoQuestão 53569
UFPR
(UFPR - 2016 - 2ª FASE)
Peptídeos são formados pela combinação de aminoácidos, por meio de ligações peptídicas. O aspartame, um adoçante cerca de 200 vezes mais doce do que a sacarose (açúcar de mesa), é um peptídeo formado pela combinação entre fenilalanina na forma de éster metílico e ácido aspártico. O aspartame é formado pela ligação peptídica entre o grupo amino da fenilalanina com o grupo ácido carboxílico do ácido aspártico, em que uma molécula de água é liberada na reação em que se forma essa ligação.
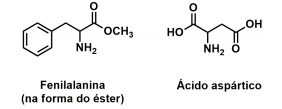
a) Apresente a estrutura do aspartame (notação em bastão).
b) Identifique na estrutura do aspartame a ligação peptídica citada.
c) Qual é a função química que corresponde à ligação peptídica?
Ver questão