FUVEST 2007
Questão 44768
FUVEST
(FUVEST - 2007 - 2 fase - Questão 1)
Um determinado agente antimofo consiste em um pote com tampa perfurada, contendo 80 g de cloreto de cálcio anidro que, ao absorver água, se transforma em cloreto de cálcio diidratado (CaCl2 . 2H2O). Em uma experiência, o agente foi mantido durante um mês em ambiente úmido. A cada 5 dias, o pote foi pesado e registrado o ganho de massa:
a) Construa, na folha de respostas ao lado, o gráfico que representa o ganho de massa versus o número de dias.
b) Qual o ganho de massa quando todo o cloreto de cálcio, contido no pote, tiver se transformado em cloreto de cálcio diidratado? Mostre os cálculos.
c) A quantos dias corresponde o ganho de massa calculado no item anterior? Indique no gráfico, utilizando linhas de chamada.
folha de respostas
Ver questão
Questão 44769
FUVEST
(FUVEST - 2007 - 2 fase - Questão 3)
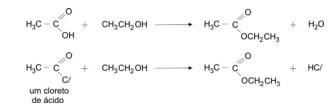
Ésteres podem ser preparados pela reação de ácidos carboxílicos ou cloretos de ácido, com álcoois, conforme exemplificado:
Recentemente, dois poliésteres biodegradáveis (I e II) foram preparados, utilizando, em cada caso, um dos métodos citados.
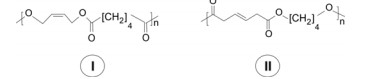
a) Escreve a fórmula mínima da unidade estrutural que se repete ´´n´´ vezes na estrutura I.
Dentre os seguintes compostos,
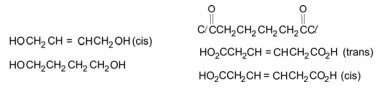
quais são os reagentes apropriados para a preparação de
b) I?
c) II?
Ver questãoQuestão 44770
FUVEST
(FUVEST - 2007 - 2 fase - Questão 4)
Na produção de hidrogênio por via petroquímica, sobram traços de CO e CO2 nesse gás, o que impede sua aplicação em hidrogenações catalíticas, uma vez que CO é veneno de catalisador. Usando-se o próprio hidrogênio, essas impurezas são removidas, sendo transformadas em CH4 e H2O. Essas reações ocorrem a temperaturas elevadas, em que reagentes e produtos são gasosos, chegando a um equilíbrio de constante KI no caso do CO e a um equilíbrio de constante KII no caso do CO2. O gráfico traz a variação dessas constantes com a temperatura.
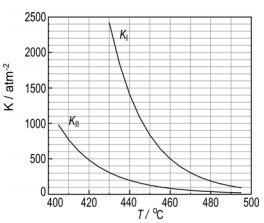
a) Num experimento de laboratório, realizado a 460 oC, as pressões parciais de CO, H2, CH4 e H2O, eram, respectivamente, 4 x 10-5 atm; 2 atm; 0,4 atm; e 0,4 atm. Verifique se o equilíbrio químico foi alcançado. Explique.
b) As transformações de CO e CO2 em CH4 mais H2O são exotérmicas ou endotérmicas? Justifique sua resposta.
c) Em qual das duas transformações, na de CO ou na de CO2, o calor desprendido ou absorvido é maior? Explique, em termos do módulo da quantidade de calor envolvida.
Questão 44771
FUVEST
(FUVEST - 2007 - 2 fase - Questão 5)
Foi realizado o seguinte experimento, em quatro etapas:
I) Em um copo de vidro, contendo alguns pregos de ferro lixados, foi colocada uma solução de tintura de iodo (iodo em solução de água e álcool comum, de cor castanho-avermelhada), em quantidade suficiente para cobrir os pregos. Depois de algumas horas, observou-se descoloração da solução.
II) A solução descolorida foi despejada em um outro copo, separando-se-a dos pregos.
III) À solução descolorida, foram adicionadas algumas gotas de água sanitária (solução aquosa de hipoclorito de sódio, cujo pH é maior que 7). Observou-se o reaparecimento imediato da cor castanho-avermelhada e formação de um precipitado.
IV) Adicionaram-se, à mistura heterogênea obtida em III, algumas gotas de ácido clorídrico concentrado. A solução continuou castanho-avermelhada, mas o precipitado foi dissolvido.
a) Escreva a equação química balanceada para a reação que ocorre na etapa I.
b) Quais os produtos das transformações que ocorrem na etapa III?
c) Escreva a equação química balanceada para a reação que ocorre na etapa IV.

Questão 44772
FUVEST
(FUVEST - 2007 - 2 fase - Questão 6)
A Agência Nacional do Petróleo (ANP) estabelece que o álcool combustível, utilizado no Brasil, deve conter entre 5,3% e 7,4% de água, em massa. Porcentagens maiores de água significam que o combustível foi adulterado. Um método que está sendo desenvolvido para analisar o teor de água no álcool combustível consiste em saturá-lo com cloreto de sódio, NaCl, e medir a condutividade elétrica da solução resultante. Como o NaCl é muito solúvel em água e pouco solúvel em etanol, a quantidade de sal adicionada para saturação aumenta com o teor de água no combustível. Observa-se que a condutividade elétrica varia linearmente com o teor de água no combustível, em um intervalo de porcentagem de água que abrange os limites estabelecidos pela ANP.
a) Explique por que o etanol (CH3CH2OH) forma mistura homogênea com água em todas as proporções.
b) Faça um desenho, representando os íons Na+ e Cl- em solução aquosa e mostrando a interação desses íons com as moléculas de água.
c) Esboce um gráfico que mostre a variação da condutividade elétrica da mistura combustível, saturada com NaCl , em função do teor de água nesse combustível. Justifique por que o gráfico tem o aspecto esboçado.
Ver questãoQuestão 44773
FUVEST
(FUVEST - 2007 - 2 fase - Questão 7)
Existem vários tipos de carvão mineral, cujas composições podem variar, conforme exemplifica a tabela a seguir.
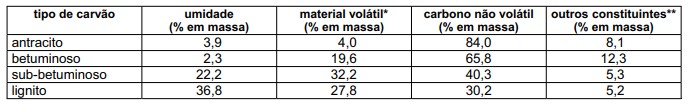
*Considere semelhante a composição do material volátil para os quatro tipos de carvão.
** Dentre os outros constituintes, o principal composto é a pirita, Fe2+ S2-2.
a) Qual desses tipos de carvão deve apresentar menor poder calorífico (energia liberada na combustão por unidade de massa de material)? Explique sua resposta.
b) Qual desses tipos de carvão deve liberar maior quantidade de gás poluente (sem considerar CO e CO2) por unidade de massa queimada? Justifique sua resposta.
c) Escreva a equação química balanceada que representa a formação do gás poluente a que se refere o item b (sem considerar CO e CO2).
d) Calcule o calor liberado na combustão completa de 1,00 x 103 kg de antracito (considere apenas a porcentagem de carbono não volátil).
Dados:
entalpia de formação do dióxido de carbono gasoso .... – 400 kJ/mol
massa molar do carbono ..............………………............ 12 g/mol
Ver questãoQuestão 44774
FUVEST
(FUVEST - 2007 - 2 fase - Questão 8)
Uma técnica de análise química consiste em medir, continuamente, a massa de um sólido, ao mesmo tempo em que é submetido a um aquecimento progressivo. À medida em que o sólido vai se decompondo e liberando produtos gasosos, sua massa diminui e isso é registrado graficamente. Por exemplo, se aquecermos AgNO3(s) anidro, por volta de 470 oC, esse sal começará a se decompor, restando prata metálica ao final do processo.
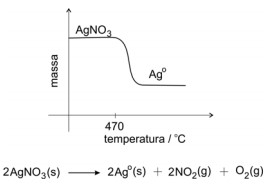
No caso do oxalato de cálcio monoidratado, CaC2O4 . H2O (s) , ocorre perda de moléculas de água de hidratação, por volta de 160 oC; o oxalato de cálcio anidro então se decompõe, liberando monóxido de carbono (na proporção de 1 mol : 1 mol), por volta de 500 oC; e o produto sólido resultante, finalmente, se decompõe em óxido de cálcio, por volta de 650 oC.
a) Escreva as equações químicas balanceadas, correspondentes aos três processos sucessivos de decomposição descritos para o CaC2O4 . H2O (s).
b) Esboce o gráfico que mostra a variação de massa, em função da temperatura, para o experimento descrito.
Ver questãoQuestão 44775
FUVEST
(FUVEST - 2007 - 2 fase - Questão 9)
O Brasil é campeão de reciclagem de latinhas de alumínio. Essencialmente, basta fundi-las, sendo, entretanto, necessário compactá-las, previamente, em pequenos fardos. Caso contrário, o alumínio queimaria no forno, onde tem contato com oxigênio do ar.
a) Escreva a equação química que representa a queima do alumínio.
b) Use argumentos de cinética química para explicar por que as latinhas de alumínio queimam, quando jogadas diretamente no forno, e por que isso não ocorre, quando antes são compactadas? Uma latinha de alumínio vazia pode ser quebrada em duas partes, executando-se o seguinte experimento:
- Com uma ponta metálica, risca-se a latinha em toda a volta, a cerca de 3 cm do fundo, para remover o revestimento e expor o metal
. - Prepara-se uma solução aquosa de CuCl2, dissolvendo-se 2,69 g desse sal em 100 mL de água. Essa solução tem cor verde-azulada.
- A latinha riscada é colocada dentro de um copo de vidro, contendo toda a solução aquosa de Cu Cl2, de tal forma a cobrir o risco. Mantém-se a latinha imersa, colocando-se um peso sobre ela. Após algum tempo, observa-se total descoramento da solução e formação de um sólido floculoso avermelhado tanto sobre o risco, quanto no fundo da latinha. Um pequeno esforço de torção sobre a latinha a quebra em duas partes.
c) Escreva a equação química que representa a transformação responsável pelo enfraquecimento da latinha de alumínio.
d) Calcule a massa total do sólido avermelhado que se formou no final do experimento, ou seja, quando houve total descoramento da solução.
Dados: massas molares (g/mol)
Cu .......... 63,5
Cl ........... 35,5
Ver questão
Questão 44789
FUVEST
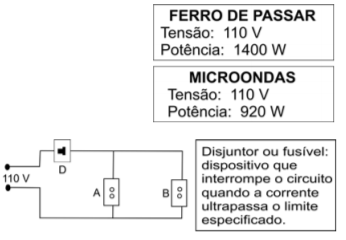
(FUVEST - 2007 - 1a fase) Na cozinha de uma casa, ligada à rede elétrica de 110 V, há duas tomadas A e B. Deseja-se utilizar, simultaneamente, um forno de microondas e um ferro de passar, com as características indicadas. Para que isso seja possível, é necessário que o disjuntor (D) dessa instalação elétrica, seja de, no mínimo,
Ver questão
Questão 44792
FUVEST
(FUVEST - 2007 - 1a fase) Uma bússola é colocada sobre uma mesa horizontal, próxima a dois fios compridos, F1 e F2, percorridos por correntes de mesma intensidade. Os fios estão dispostos perpendicularmente à mesa e a atravessam. Quando a bússola é colocada em P, sua agulha aponta na direção indicada. Em seguida, a bússola é colocada na posição 1 e depois na posição 2, ambas eqüidistantes dos fios. Nessas posições, a agulha da bússola indicará, respectivamente, as direções
Ver questão