FUVEST 2022
Questão 77638
UFPR
(UFPR - 2022- 2ª fase)
Os ácidos carboxílicos compõem uma classe de substâncias orgânicas presentes no dia a dia. A ardência de uma picada de formiga, o sabor azedo das frutas cítricas e até mesmo as dores musculares depois de um dia de atividade física intensa são causados por ácidos carboxílicos. O produto de uso cotidiano mais comum que contém um ácido carboxílico é o vinagre. Geralmente na forma de uma solução a 5% de um ácido carboxílico em particular, o vinagre é utilizado na preparação de molhos e conservas ou diretamente como tempero. Além disso, os ácidos carboxílicos podem ser convertidos em outras substâncias denominadas “derivados de ácidos carboxílicos”.
a) Apresente a estrutura química (em grafia bastão) da substância carboxilada presente no vinagre e indique o nome dessa substância.
b) A substância carboxilada presente no vinagre pode ser transformada em um derivado com a fórmula . Forneça a estrutura (em grafia bastão) desse derivado e indique a qual classe de derivados de ácido carboxílico o composto de fórmula
pertence.
Questão 77639
UFPR
(UFPR - 2022- 2ª fase)
Recentemente, cientistas divulgaram um estudo que indicaria a presença da molécula fosfina, constituída por um átomo de fósforo (Z = 15) e três átomos de hidrogênio (Z = 1), na atmosfera de Vênus. O estudo teve grande repercussão porque a presença dessa molécula sugere o envolvimento de microrganismos anaeróbicos naquele planeta. Esses microrganismos seriam capazes de absorver fosfato de minerais e materiais biológicos e expelir a fosfina no ambiente. No entanto, novos estudos refutaram aquele trabalho, indicando que na verdade trata-se da presença de outra molécula formada em processos que não dependem de microrganismos.
WITZE, A. Life on Venus claim faces strongest challenge yet. Nature, v. 590, 28 jan. 2021. Disponível em: https://www.nature.com/articles/d41586-021-00249-y.
Diante do exposto, responda o que se pede.
a) Escreva a distribuição eletrônica em níveis de energia do átomo de fósforo.
b) Construa uma estrutura de Lewis para a molécula de fosfina, indicando claramente os pares de elétrons ligantes e isolados.
c) O fósforo é um elemento essencial para os organismos vivos. Indique o nome de duas classes de biomoléculas que contêm fósforo.
d) Na natureza, um dos principais minérios que contêm fósforo é a apatita, constituído principalmente por fosfato de cálcio. O íon fosfato, derivado do ácido fosfórico, combina-se com íons cálcio e forma um sal insolúvel em água. Qual é a fórmula mínima do sal fosfato de cálcio?
Questão 77640
UFPR
(UFPR - 2022- 2ª fase)
As impressionantes imagens da explosão num depósito de nitrato de amônio no porto de Beirute mostraram o poder de detonação desse composto utilizado como fertilizante. De acordo com as informações oficiais, havia 2750 toneladas de nitrato de amônio estocadas no depósito. Com a explosão, parte da cidade foi destruída, resultando em centenas de mortos e milhares de feridos. Uma onda de choque foi sentida a mais de 200 km de distância. O nitrato de amônio à temperatura ambiente é estável, não é volátil nem inflamável, porém pode explodir se for mantido em confinamento e na presença de uma fonte de detonação. É necessário evitar temperaturas acima de 210 ºC, em que o nitrato de amônio sofre decomposição. Uma série de reações ocorre acima dessa temperatura e a principal reação envolvida na explosão do nitrato de amônio é mostrada na equação a seguir:
A quantidade de energia liberada numa explosão é normalmente referenciada em equivalência de tonelada de TNT (trinitrotolueno), que corresponde ao “ton”. Um “kiloton”, que equivale a 103 toneladas (de TNT), é a unidade de energia igual a 4,2 x 1012 joules.
Dado: 1 tonelada = 106 g.
a) Calcule a massa de que corresponde à quantidade de matéria de 8 mol presente na equação mostrada. Apresente como você calculou esse valor.
b) Considerando que apenas a reação mostrada na equação ocorra na explosão, calcule a quantidade de energia liberada (em J) a partir da massa de contida naquele depósito. Mostre os cálculos detalhadamente
c) Calcule a quantidade equivalente em kiloton (de TNT) para essa explosão. Mostre como você chegou ao valor.
Ver questãoQuestão 77641
UFPR
(UFPR - 2022- 2ª fase)
Tendo em vista que o lítio é empregado em baterias recarregáveis, a demanda por esse elemento vem aumentando expressivamente, sendo alavancada em especial pela indústria de carros elétricos. Uma das fontes naturais desse elemento é o mineral espodumênio, que é tratado com ácido sulfúrico para extrair o lítio, conforme a equação química a seguir:
O é dissolvido em água, separado do resíduo sólido e em seguida precipitado na forma do produto desejado. Quando se usa
como agente precipitante, o produto obtido é
.
Considerando as informações apresentadas, responda o que se pede.
(Considere as massas atômicas: Al=27; C=12; H=1; Li=7; O=16; S=32; Si=28.)
a) Qual é a massa molar do em g mol-1?
b) A partir de 100 g de , qual é a massa do
a ser obtido em gramas?
c) Escreva a equação química balanceada da precipitação de a partir de
e
, indicando os estados de agregação de cada substância.
Questão 77642
UFPR
(UFPR - 2022- 2ª fase)
A reação de redução de um composto carbonilado com borohidreto de sódio é uma das transformações mais utilizadas nos laboratórios de química orgânica, especialmente por conta dos altos rendimentos e da facilidade de manipulação dos reagentes. Nessa reação, o íon borohidreto transfere os seus hidrogênios, na forma de hidretos, para a carbonila de um aldeído ou uma cetona, formando um intermediário denominado alcóxido. No fim da reação, a adição de ácido clorídrico leva ao produto, como mostrado no esquema simplificado a seguir:
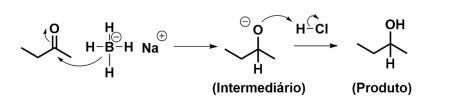
Considerando o esquema apresentado, responda o que se pede.
a) A qual classe de compostos orgânicos pertence o produto da reação mostrada?
b) Considerando que todos os hidrogênios do íon borohidreto são transferidos (cada um para uma molécula de butanona diferente), qual é a massa (em gramas) de borohidreto de sódio necessária para transformar 144 g da butanona no produto correspondente? Apresente os cálculos, assumindo que as massas molares são: butanona = 72 g mol-1;
= 38 g mol-1 e produto = 74 g mol-1.
c) Qual seria a estrutura do produto formado se o composto carbonilado empregado na reação fosse o butanal (butiraldeído)? Apresente a estrutura do produto (em grafia bastão).
Ver questãoQuestão 77643
UFPR
(UFPR - 2022- 2ª fase)
Os compostos but-1-eno e but-2-eno são isômeros constitucionais de posição. O but-2-eno pode apresentar isomeria geométrica, ou seja, pode ocorrer na forma do (E)-but-2-eno e (Z)-but-2-eno. Ambos os compostos (but-1-eno e but-2-eno) podem sofrer hidrogenação catalisada por metal levando a um produto com fórmula . Com base nos conhecimentos de química orgânica e diante do exposto, faça o que se pede.
a) Apresente e identifique corretamente as estruturas (em grafia bastão) dos isômeros but-1-eno e but-2-eno.
b) Apresente e identifique corretamente as estruturas (em grafia bastão) dos isômeros (E)-but-2-eno e (Z)-but-2-eno
c) Apresente a estrutura (em grafia bastão) e forneça o nome do composto de fórmula citado como produto da hidrogenação dos compostos but-1-eno e but-2-eno.
Questão 77644
UFPR
(UFPR - 2022- 2ª fase)
Antes do desenvolvimento de equipamentos e técnicas modernas, os químicos tinham de se basear apenas em estudos de reatividade e de síntese de compostos para propor a estrutura geométrica das moléculas. Supondo-se que nessa época era conhecido um composto de fórmula , poder-se-ia propor dois arranjos geométricos de quatro átomos ao redor do átomo de carbono central: planar (quadrado) ou tetraédrico. Todas as tentativas de sínteses produziram somente uma mesma substância de fórmula
, o que descartava a existência de isômeros.
a) Assumindo-se o arranjo geométrico como sendo planar (quadrado), haveria isômeros? Justifique a resposta com desenhos esquemáticos das possíveis estruturas para esse arranjo.
b) Assumindo-se o arranjo geométrico como sendo tetraédrico, haveria isômeros? Justifique a resposta com desenhos esquemáticos das possíveis estruturas para esse arranjo.
c) Qual é o arranjo geométrico da molécula coerente com o fato exposto no texto? Justifique sua resposta.
Ver questãoQuestão 77645
UFPR
(UFPR - 2022- 2ª fase)
Um reservatório de água possui o formato de um prisma reto com 4 metros de altura e base quadrada com 2 metros de lado, conforme ilustra a figura ao lado.

a) Calcule o volume desse reservatório, em metros cúbicos. Justifique sua resposta.
b) Suponha que esse reservatório esteja vazio e será preenchido com água a uma razão de 16 litros por minuto. Quantos minutos serão necessários para que o reservatório fique completamente cheio? Justifique sua resposta.
Ver questãoQuestão 77646
UFPR
(UFPR - 2022- 2ª fase)
Para verificar a segurança de vacinas em fase de desenvolvimento, pesquisadores realizam testes com voluntários que, de forma aleatória, recebem uma dose da vacina ou uma dose de uma substância neutra denominada placebo. Na etapa seguinte do teste, esses voluntários são separados em dois grupos:
Grupo A: voluntários que receberam o placebo;
Grupo B: voluntários que receberam a vacina.
O quociente entre o número de voluntários do Grupo B que tiveram algum efeito colateral e o número total de voluntários do Grupo B determina a probabilidade de ocorrência de efeitos colaterais dessa vacina. Quanto menor for essa probabilidade, mais segura será a vacina.
Na tabela a seguir, temos o resultado de um teste realizado com duas vacinas (Vacina 1 e Vacina 2).

Com base nos dados fornecidos, responda o que se pede.
a) Escolhendo-se aleatoriamente um voluntário que participou do teste da Vacina 1, qual é a probabilidade de que esse voluntário tenha apresentado efeitos colaterais no teste? Justifique sua resposta.
b) Qual das duas vacinas é a mais segura? Justifique sua resposta.
Ver questãoQuestão 77647
UFPR
(UFPR - 2022- 2ª fase)
Considere os triângulos OQP e QRS indicados no plano cartesiano ao lado. O ponto S está sobre a reta horizontal l, de equação , com
, e os pontos P,Q e S estão sobre a reta r. Com base nessas informações, responda o que se pede.

a) Calcule a área do triângulo OQP em função do valor . Justifique sua resposta.
b) Para qual valor de , a área do triângulo QRS é metade da área do triângulo OQP? Justifique sua resposta.