FUVEST 2024
Questão 82492
FUVEST
(FUVEST - 2024)
Um estudo recente feito por pesquisadores do Caltech(1) mostrou que, desde o início do século XXI, o volume de gelo acumulado no oceano Ártico durante o inverno diminuiu em cerca de 6000 km3 , redução em grande parte impulsionada pela mudança na espessura do gelo, passando de um padrão denominado “plurianual” para outro padrão conhecido como “gelo marinho sazonal”. Segundo os autores do estudo, o gelo mais antigo e plurianual tende a ser mais espesso e, portanto, seu derretimento é mais demorado. À medida que esse “reservatório” de gelo “antigo” marinho do Ártico se esgota e o gelo sazonal passa a predominar, espera-se que a espessura e o volume globais do gelo marinho do Ártico diminuam.
a) Estime, em kg, o acréscimo na massa de água no oceano devido ao degelo no Ártico desde o início do século XXI.
b) Sabendo que a área do oceano Ártico é de aproximadamente , se todo esse gelo perdido formasse uma camada sobre a superfície desse oceano, qual seria a espessura dessa camada?
c) Estime a mínima quantidade de energia (em joules) para derreter completamente uma tonelada de gelo inicialmente a uma temperatura de -20°C.
Note e adote: Propriedades do gelo (plurianual ou sazonal):
- Densidade = 0,92 g/cm3
- Calor específico =
J/kg.°C
- Calor latente de fusão =
(1) Sahra Kacimi et al, “Arctic snow depth, ice 3/4 thickness and volume from ICESat‐2 and CryoSat‐2: 2018‐2021”, Geophysical Research Letters (2022). DOI: 10.1029/2021GL097448
Ver questãoQuestão 82493
FUVEST
(FUVEST - 2024)
No manual de instalação de um filtro de torneira, consta a seguinte mensagem:

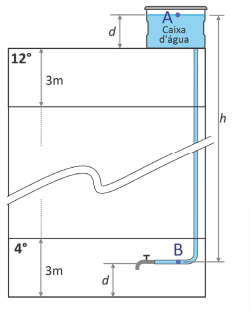
a) Calcule a força sobre um tampão de vedação colocado na ponta de um cano de 40 mm de diâmetro se a pressão da água no interior do cano neste local é de 100 kPa.
b) Considere que uma torneira esteja instalada no 4º andar de um prédio de 12 andares (ponto B) e esteja conectada a uma caixa d’água localizada na laje desse prédio (ponto A), conforme a figura. Calcule a distância vertical ℎ e a diferença de pressão entre os pontos B e A.
c) Para um filtro instalado em um apartamento de outro andar (sem o redutor de vazão), verifica-se que o tempo para encher um copo de 240 mL é de 5 s. Dado que o diâmetro da saída do filtro é de 4 mm, calcule a velocidade da água na saída do filtro (em m/s).
Note e adote:
- A altura padrão de cada andar de um prédio é de 3 metros.
- Considere a água como um fluido ideal com densidade de 1000 kg/m3 .
- A vazão de um fluido em regime de fluxo constante é dada pelo produto da velocidade do fluido pela área da seção reta do tubo de escoamento.
- Aceleração da gravidade (g) = 10 m/s2
- Considere
.
Questão 82494
FUVEST
(FUVEST - 2024)
Considere uma mesma corda de violoncelo vibrando, em situações distintas, conforme os padrões de ondas estacionárias mostrados nos diagramas a seguir, em que a amplitude das vibrações, por clareza, está grandemente ampliada. No diagrama 1, a corda vibra no comprimento L mostrado na figura. No diagrama 2, a corda está pinçada a 2/3 do comprimento L, de modo que não há vibração no terço restante.

a) Um aluno afirma que, por se tratar de padrões estacionários, a velocidade de propagação de uma onda qualquer na corda é nula. Essa afirmação é correta? Justifique a sua resposta.
b) Considere agora a situação mostrada no diagrama 1. Se o comprimento L fosse de 60 cm, qual seria o comprimento de onda da vibração mostrada nesse diagrama?
c) Suponha agora que a frequência da vibração da corda no padrão mostrado no diagrama 1 seja de 220 Hz. Determine a frequência de vibração da corda no padrão mostrado no diagrama 2.
Ver questãoQuestão 82495
FUVEST
(FUVEST - 2024)
Considere uma amostra de 2 mols de um gás monoatômico, em que cada átomo possui uma massa de aproximadamente gramas. O gás pode ser tratado como ideal.
a) Determine a massa total do gás na amostra, em gramas.
b) A energia interna da amostra a uma temperatura de 300 K é de 7500 J. Quanta energia é preciso transferir para a amostra para que sua temperatura atinja 400 K?
c) A descoberta de Einstein sobre a equivalência entre massa e energia é válida mesmo em fenômenos mais familiares, como o aquecimento de um fluido, embora, nesse caso, o efeito seja muito pequeno para ser perceptível. Nesse contexto, calcule a variação na massa da amostra de gás do enunciado quando ela experimenta um processo de expansão ao longo do qual recebe 13500 J de calor do entorno e realiza um trabalho de 4500 J.
Note e adote:
- Número de Avogadro:
- Relação de Einstein:
- Velocidade da luz no vácuo:
Questão 82496
FUVEST
(FUVEST - 2024)
Um período da vida do físico J. Robert Oppenheimer pouco retratado no recente filme Oppenheimer é o seu Doutorado na Alemanha sob a orientação de Max Born. Em 1927, eles publicaram um trabalho muito importante, que se tornaria uma das bases da física atômica e molecular. A chamada Aproximação de Born‐Oppenheimer usa o fato de que a massa dos núcleos é muito maior que a massa dos elétrons para justificar um tratamento independente do movimento dos núcleos e o dos elétrons em átomos e moléculas.
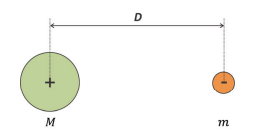
Para ilustrar a validade da aproximação, considere um modelo clássico para o átomo de hidrogênio composto de um próton de massa M e carga +e e um elétron de massa m e carga -e separados por uma distância D, como mostra a figura.
a) Considerando o sistema inicialmente estático, desenhe, na folha de respostas, os vetores das forças elétricas que atuam sobre as duas partículas.
Considere agora que as velocidades das cargas estão sempre em sentidos opostos e perpendiculares à linha que une os seus centros, como mostra a figura. Considere também que a única força que atua sobre as partículas é a força elétrica entre elas, de modo que a quantidade de movimento total (ou momento linear total) do sistema é nula. Considere ainda que ambas as cargas estejam em movimento circular uniforme em torno do centro de massa do sistema, de modo que distância entre as duas partículas não se altere.
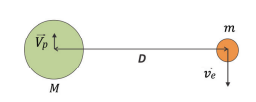
b) Sendo , calcule a razão
entre os intervalos de tempo que o elétron e o pósitron, respectivamente, levam para percorrer um arco de circunferência de mesmo comprimento 𝛥𝑠.
c) Na aproximação de Born-Oppenheimer, pode ser feita a hipótese de que o próton permanece em repouso enquanto o elétron gira em torno dele. Utilizando essa hipótese e supondo ainda que a trajetória do elétron seja uma circunferência de raio D, calcule a energia cinética do elétron em termos de e, de D e da constante eletrostática da Lei de Coulomb .
Questão 82497
FUVEST
(FUVEST - 2024)
O fenômeno da aurora polar, há muito tempo conhecido nos hemisférios norte e sul do planeta Terra, caracteriza-se por um brilho observado no céu em decorrência de colisões entre os átomos da atmosfera, predominantemente oxigênio e nitrogênio, e as partículas (prótons e elétrons) lançadas por erupções solares e canalizadas pelo campo magnético terrestre.
a) Determine a velocidade (em m/s) de um próton com energia cinética de .
b) Considerando agora elétrons com velocidade de 1,6×106 m/s e que descrevam órbitas circulares sob ação do campo magnético terrestre, cuja intensidade é de 10-4 T, calcule o módulo da força magnética atuando sobre cada elétron.
As diferentes cores observadas na aurora devem-se à emissão de fótons em processos de desexcitação de átomos presentes nas diferentes camadas da atmosfera. As cores mais comuns da luz associada a esses fótons são a verde e a vermelha, devido à predominância de oxigênio e nitrogênio nas altitudes de 200 km e 100 km, respectivamente.
c) Calcule (em joules) a variação da energia de um átomo quando este emite um fóton da cor verde.

Questão 82498
FUVEST
(FUVEST - 2024)
O ácido fosfórico (H3PO4) é um importante produto químico usado na produção de fertilizantes, detergentes e na indústria alimentícia. A produção de H3PO4 pode ocorrer por dois processos distintos. No processo úmido, faz-se reagir rocha fosfática (Ca5(PO4)3F) com ácido sulfúrico. Outra opção é oxidar o fósforo elementar (P4) com oxigênio gasoso para formar o P4O10 e, em seguida, reagir essa espécie com água formando o ácido fosfórico.
a) Considerando Ca5(PO4)3F e P4O10, qual das duas espécies possui o maior teor de P em massa? Justifique a sua resposta mostrando os cálculos.
b) Apresente, na tabela da folha de repostas, a equação da reação global balanceada para a produção de ácido fosfórico a partir do P4 e o número de oxidação do fósforo no reagente e no produto.
c) Um volume de 10 mL de um refrigerante previamente desgaseificado foi adicionado em um balão volumétrico de 50 mL, que foi completado com água destilada. Essa solução foi analisada e obteve-se uma concentração de 0,2 g/L de ácido fosfórico. Considerando que o valor máximo de ácido fosfórico permitido em refrigerantes é de 0,07 g para cada 100 mL, a concentração de ácido fosfórico nesse refrigerante encontra-se dentro do limite permitido pela legislação? Justifique a sua resposta mostrando os cálculos.
Note e adote: Massas molares (g/mol):
- Ca5(PO4)3F = 504;
- P4O10 = 284;
- P = 31
Questão 82499
FUVEST
(FUVEST - 2024)
A intolerância à lactose é uma condição causada pela incapacidade de digerir a lactose, que é o açúcar do leite. Essa condição impede a quebra da lactose em dois monossacarídeos – os isômeros glicose e galactose.
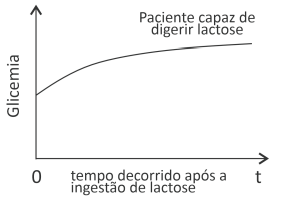
Para verificar essa condição, pode-se administrar lactose ao paciente e acompanhar a concentração de glicose no seu sangue (glicemia) ao longo do tempo.
a) Na folha de respostas, é apresentada uma curva que representa a glicemia ao longo do tempo de um paciente capaz de digerir a lactose. Esboce, na mesma figura, a curva esperada em um exame positivo para intolerância à lactose, partindo-se da mesma glicemia inicial.
Produtos chamados “zero lactose” são tratados com lactase na sua produção. A lactase é a enzima que transforma lactose em glicose e galactose de forma a mitigar o efeito da lactose no organismo. A seguir, são apresentas tabelas nutricionais para o mesmo leite, nas versões “não tratado” e “tratado apenas com lactase”.
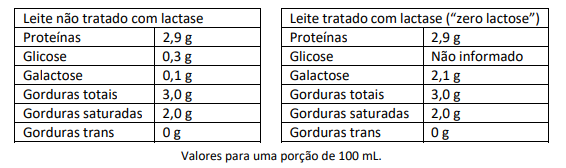
b) Qual massa de glicose, em gramas, deveria ser informada na tabela nutricional do leite “zero lactose”? Justifique a sua resposta.

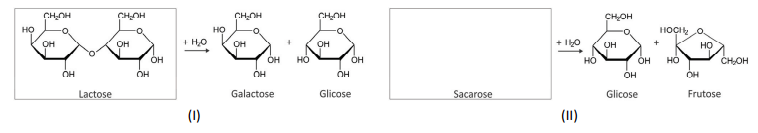
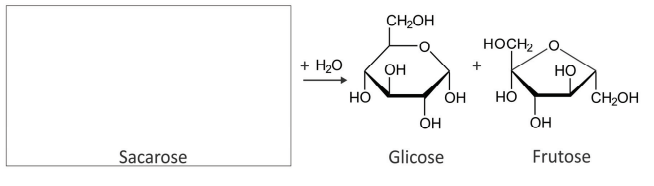
c) A quebra da lactose em galactose e glicose, ilustrada a seguir (I), ocorre de forma semelhante à quebra da sacarose, que produz glicose e frutose (II). Considerando o esquema, complete, no espaço reservado na folha de respostas, a estrutura da sacarose.
Questão 82501
FUVEST
(FUVEST - 2024)
As interações entre as bases nitrogenadas do DNA são fundamentais para a manutenção da vida. Normalmente, essas interações ocorrem por ligações de hidrogênio, conforme proposto no modelo de Watson-Crick. Entretanto, existe também o modelo de Hoogsteen. A interação entre as bases adenina (A) e timina (T) para a formação do par A-T para ambos os modelos está representada a seguir:
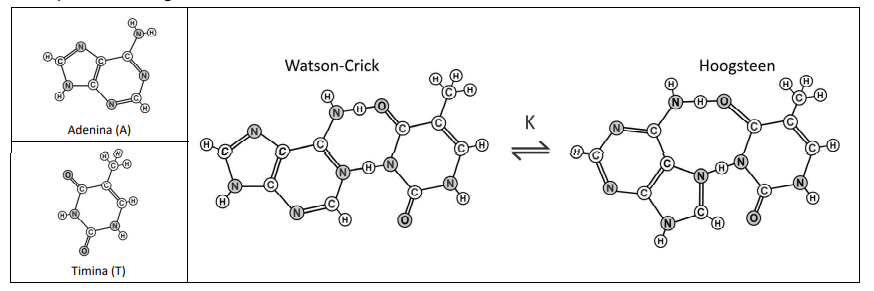
a) Nas estruturas representadas na folha de respostas, circule as interações que são responsáveis por manter essas bases pareadas.
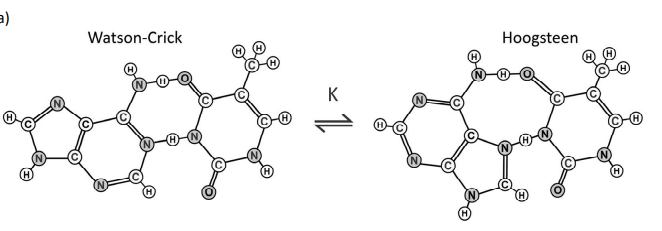
b) Considerando que esses dois tipos de pareamento estão em equilíbrio e que, comumente, o pareamento de Watson-Crick é predominante, a constante de equilíbrio K do processo representado é menor, maior ou igual a 1? Justifique a sua resposta.
O mecanismo de funcionamento de alguns fármacos para combate ao câncer, como os agentes alquilantes, depende da inserção de um grupo alquila nas bases de DNA, conforme representado esquematicamente a seguir para grupamentos amina das bases nitrogenadas.
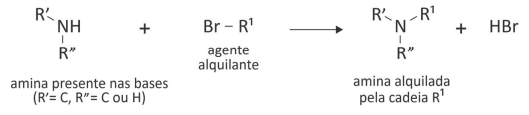
c) A molécula de adenina consumiria mais, menos ou a mesma quantidade de agente alquilante do que a timina consumiria para bloquear todos os seus grupos suscetíveis à reação de alquilação ilustrada? Considere um rendimento de 100% e justifique a sua resposta com base nas diferenças estruturais entre as moléculas.
Ver questãoQuestão 82502
FUVEST
(FUVEST - 2024)
O motor de um automóvel produz monóxido de carbono (CO) à taxa de, aproximadamente, 200 g de CO por hora. O CO é tóxico pois compete com o O2 para se ligar à hemoglobina (Hb), formando HbCO, que impede o transporte de oxigênio pela oxi-hemoglobina (HbO2). Por esse motivo, em alguns países, é comum a instalação de sensores para a detecção de CO em garagens fechadas. Cabe destacar que esse gás não reage com o O2 atmosférico em condições normais, de modo que o CO pode se acumular e atingir concentrações letais.

a) Explique, com base no equilíbrio HbCO + O2 ⇌ HbO2 + CO, por que o tratamento para intoxicação por CO é administrar oxigênio em alta concentração aos pacientes.
b) Uma forma de detectar CO é pelo uso de um sensor colorimétrico. Quando exposto ao CO, um dos sais presentes no sensor sofre redução, mudando de cor, enquanto o CO é oxidado a CO2, conforme representado a seguir:
CO + Sal (forma oxidada) → CO2 + Sal (forma reduzida)
Com base no processo descrito e na reação apresentada, é correto afirmar que o sal atua como catalisador da reação de oxidação do CO a CO2? Justifique a sua resposta.
c) Suponha que um carro foi deixado ligado em uma garagem com 6,0 m de comprimento, 4,0 m de largura e 2,0 m de altura, sem ventilação. Quantas horas levaria para a produção de CO atingir a concentração tóxica de 10 mg/L? Justifique a sua resposta mostrando os cálculos.
Ver questão