ITA 2024
Questão 81901
ITA
(ITA - 2024)
Para cada par de substâncias abaixo, indique qual apresenta maior ponto de fusão e justifique sua indicação.
a) Benzeno ou Naftaleno
b) Ácido etanoico ou Propanona
c) H2O ou D2O
d) CSe2 ou CS2
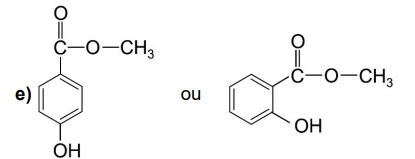
Questão 81902
ITA
(ITA - 2024)
Considere as seguintes substâncias:
I. 2-metil-1-butanol
II. 3-metil-2-butanol
Escreva as equações químicas que descrevem as reações abaixo, apresentando a fórmula estrutural dos compostos orgânicos envolvidos, ou seja, reagentes, eventuais produtos intermediários e produtos finais.
a) I com excesso de agente oxidante.
b) II com excesso de agente oxidante.
c) II com o produto final da reação do item a), em meio ácido.
d) Produto orgânico final do item b) com NaBH4(aq), seguido de tratamento com ácido diluído.
Ver questãoQuestão 81903
ITA
(ITA - 2024)
São descritos dois experimentos (Exp. 1 e Exp. 2) a respeito de uma solução aquosa de uma substância A, de massa molar igual a 50 g mol-1, que não se dissocia e não se volatiliza. Os experimentos foram realizados a 25 °C.
Exp. 1 – Em um béquer, foram dissolvidos 100 g da substância A em 360 mL de água pura. A seguir, colocou-se o béquer em um recipiente que foi fechado.
Exp. 2 – Em um béquer denominado I, preparou-se a mesma solução descrita no Exp.1, e em outro béquer denominado II, adicionou-se 360 mL de água pura. Em seguida, os béqueres I e II foram colocados em um recipiente que foi fechado.
Considere que a solução aquosa de A se comporte idealmente, a massa específica da água seja 1 g cm3 e a pressão de vapor da água seja 23,8 Torr a 25 °C. A partir das informações acima:
a) determine os valores numéricos das frações molares da substância A e da água na solução do Exp. 1;
b) determine o valor numérico da fração molar da água na fase de vapor no Exp.1;
c) determine o valor numérico da pressão de vapor da água, em Torr, no Exp. 1;
d) desconsiderando o efeito causado pelo volume do recipiente no Exp. 2, descreva sucintamente e de forma qualitativa o que acontecerá com o volume do líquido no béquer I após o equilíbrio ter sido atingido.
Ver questãoQuestão 81904
ITA
(ITA - 2024)
Considere as semicélulas descritas e os respectivos potenciais do elemento galvânico em relação ao eletrodo padrão de hidrogênio.
Semicélula A: Ag2O(s)|Ag(s) em meio básico; E0 = 0,342 V;
Semicélula B: NbO2(s)|Nb(s) em meio ácido; E0 = - 0,690 V.
Com base nas informações fornecidas, apresente:
a) As equações químicas balanceadas que representam as semirreações, especificando o catodo e o anodo.
b) A equação química que representa a reação global.
c) O valor numérico da força eletromotriz.
Ver questãoQuestão 81905
ITA
(ITA - 2024)
Os dados da tabela abaixo foram obtidos em um estudo de determinação dos parâmetros cinéticos de uma reação hipotética e irreversível do tipo A + B → C + D.
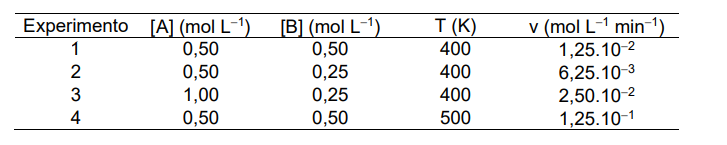
Não havendo mudança no mecanismo da reação no intervalo de temperatura considerado, determine os seguintes valores numéricos:
a) Ordem da reação em relação ao reagente A.
b) Ordem da reação em relação ao reagente B.
c) Ordem global da reação.
d) Constante de velocidade da reação a 400 K, com sua respectiva unidade de medida.
e) Constante de velocidade da reação a 500 K, com sua respectiva unidade de medida.
f) Energia de ativação da reação, em kcal mol-1.
Ver questãoQuestão 81906
ITA
(ITA - 2024)
Considere que a água destilada esteja em equilíbrio com a atmosfera, em dois ambientes distintos (I e II), nos quais a pressão parcial de CO2 foi medida em e
. Com base nessas informações e considerando apenas a primeira dissociação do ácido carbônico,
a) escreva a equação química que representa o equilíbrio entre a água e o CO2;
b) escreva uma expressão matemática para o pH da amostra de água em função da pressão parcial de CO2;
c) determine o valor numérico da diferença de entre as duas amostras de água.
Questão 81907
ITA
(ITA - 2024)
Uma solução foi preparada por meio da dissolução de 1,330 g de uma mistura de NaCl(s) e KCl(s) em água. A essa solução, foram adicionados 10 mL de uma solução 4,0 mol.L-1 em AgNO3 para precipitar todo cloreto na amostra. Posteriormente, o sólido foi removido e uma placa de zinco foi adicionada à solução sobrenadante. Após um tempo suficiente para a reação completa, verificou-se uma variação de massa de 1,506 g na placa de zinco. Com base nessas informações, determine as quantidades, em mol, de:
a) zinco consumido na placa;
b) cloreto na solução inicial;
c) NaCl(s) e KCl(s) na mistura inicial.
Ver questãoQuestão 81908
ITA
(ITA - 2024)
As resinas epoxídicas contêm pelo menos dois grupos epóxidos terminais por molécula e reagem com um agente de cura para a formação de um polímero por meio de uma reação de cura (ou reticulação). Uma forma comum de se obter resina epoxídica envolve a reação entre epicloridrina (1-cloro-2,3-epoxipropano) e bisfenol-A (4,4´dihidroxi2,2-difenilpropano).
a) Apresente a fórmula estrutural da epicloridrina e do bisfenol-A.
b) Escreva a equação química balanceada entre as substâncias do item a) para a formação de uma resina epoxídica.
c) Escreva a equação química entre um anel epóxido e o agente de cura 4,4´Diaminodifenilmetano (DDM).
Ver questãoQuestão 81909
ITA
(ITA - 2024)
Seja a reação , que apresenta lei de velocidade de primeira ordem (em relação a A) e constante de velocidade k1 igual a
a 300 K. A reação reversa,
, também é de primeira ordem (em relação a B) e, a 300 K, tem uma constante de velocidade k2 igual a um milésimo de k1. A constante de velocidade total em direção ao equilíbrio é dada pela soma das constantes de velocidade direta e reversa, e para cada aumento de 10 K na temperatura, os valores de k1 são duplicados e os de k2 são quadruplicados.
Deseja-se realizar essa reação buscando a máxima constante de velocidade total possível, mas utilizando um reator limitado a uma temperatura de trabalho de até 500 K, e mantendo um rendimento mínimo de 24,41%, representado por . Com base nessas restrições, determine:
a) qual das propriedades constitui o limitante para a operação do reator, a temperatura ou o rendimento;
b) o valor numérico da temperatura de operação;
c) o valor numérico do rendimento de operação;
d) se a constante de velocidade total na condição de operação supera o valor de 10 s-1.
Ver questãoQuestão 81910
ITA
(ITA - 2024)
Sejam as substâncias simples na forma alotrópica mais estável nas condições padrão dos elementos de números atômicos Z, (Z-2) e (Z-3). Considere que 96,0 g da substância simples gasosa de um calcogênio de número atômico Z reage estequiometricamente com
I. a substância simples sólida do elemento de número atômico (Z-2), formando aproximadamente 132,0 g de um gás;
II. a substância simples sólida do elemento de número atômico (Z-3), formando aproximadamente 139,2 g de um sólido.
Responda as questões abaixo, utilizando as informações fornecidas.
a) Identifique os elementos químicos de números atômicos Z, (Z-2) e (Z-3).
b) Apresente a equação química balanceada que representa a reação entre as substâncias simples dos elementos de números atômicos Z e (Z-2).
c) Apresente a equação química balanceada que representa a reação entre as substâncias simples dos elementos de números atômicos Z e (Z-3).
Ver questão